合格の60点以上を取るために必要最低限絞り込んだ学習ポイントと問題を盛り込んだ試験対策サイトです!
It is the exam site that incorporates the problem and learning point narrowed down the minimum required to take 60 or more points pass!
このサイトは日本国家資格の「危険物取扱者」の受験対策について記載されています。資格試験の出題箇所について独自の分析により、必要最小限の内容となっております。
This site is a national qualification in Japan, "Hazardous materials engineer" are described for exam measures. The point for your own analysis of exam questions, and ordered the contents of the minimum.
リンクや広告について
当サイトには広告や別サイトへのリンクがありますので、ご確認ください。また配信事業者はCookieを使用してウェブサイト閲覧履歴に基づく広告を配信しております。
危険物取扱者に必要な基礎化学 塩と塩基
塩と塩基
酸
水に溶けると電離して水素イオンH+を生じる物質、又は他の物質に水素イオンH+を与えることの出来る物質を酸と言います。青色のリトマス紙を赤くするのはH+の働きです。
例:
酢酸CH3COOH« H++CH3COO-
硝酸HNO3« H++NO3-
塩酸HCl« H++Cl-
塩基
水に溶けると電離して水酸化物イオンOH-を生じる物質、又は他の物質から水素イオンH+を受け取ることの出来る物質を塩基と言います。赤色のリトマス紙を青くするのはOH-の働きです。
例:
水酸化カリウムKOH« K++OH-
水酸化ナトリウムNaOH« Na++OH-
※ 酸も塩基もこんな感じに水に溶けると分解するという風に覚えておいてください。
酸と塩基の強弱分類
| 強酸 | 弱酸 | |
| 酸 | 塩酸(HCl) | 酢酸(CH3COOH) |
| 硝酸(HNO3) | 硫化水素(H2S) | |
| 硫酸(H2SO4) | ホウ酸(H3BO3) | |
| 炭酸(H2CO3) | ||
| 強塩基 | 弱塩基 | |
| 塩基 | 水酸化ナトリウム(NaOH) | アンモニア(NH3) |
| 水酸化カルシウム(Ca(OH)2) | ||
| 水酸化バリウム(Ba(OH)2) | ||
| 水酸化カリウム(KOH) |
中和反応
酸と塩基から塩と水の出来る反応を中和反応と言います。
ペーハー(水素イオン指数)
酸性や塩基性(アルカリ性)の度合いを表す際に、ペーハー(ph)で表すことがあります。
|
強 酸性 弱 |
中性 |
弱 塩基性 強 |
||||||
| 0 | 2 | 4 | 6 |
7 |
8 | 10 | 12 | 14 |
ph指示薬
指示薬は参考書に載っているものが全てではありません。何十とあり、細かい確認が可能です。
乙4類危険物取扱者の業務では使用しませんが、必要知識として覚えておいてほしいとのお達しです。
共通の知識ですから他の危険物取り扱いの基礎知識も内容として入ってくるわけです。
さて、酸と塩基の強弱は、電離度によって決まります。
電離度=電離している電解質の物質量/溶けている電解質全体の物質量 です。
※ 試験では計算をさせてくれません。指示薬と物質の暗記を求められています。
そうそう、皆さん指示薬はどんなときに使用するか分かっていますか?
小学校や中学校でリトマスを使った実験はやったと思いますが、そのときは酸性かアルカリ性を調べるのに使用しましたね。単に水溶液のpHを調べました。
危険物の物質試験でも同じくpHを調べるのですが、もう少し詳しく調べます。そのため、たくさんの指示薬を用います。そして、おおよその見当をつけて指示薬を用いますが、微妙な反応の場合は指示薬を変えて検査します。
従って、以下に述べるような事柄は決まっていることではありません。当然、覚えるようなことでもないのです。
順に指示薬を使用してゆけば、pHは調べることができるからです。そんな無駄な知識と分かっていても、試験問題になるのですからしょうが無いですね。
また、現在はpHを正確に計る検査機器がありますので・・・。
試験で取り上げられる試薬は3つです。
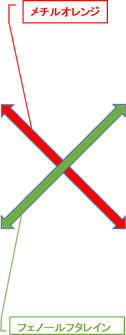
メチルオレンジ 3.1 - 4.4 赤色 - 橙色 【強酸から弱酸に反応】
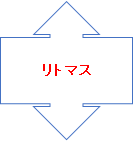
リトマス 4.5 - 8.3 赤色 - 青色 【弱酸から弱塩基に反応】
フェノールフタレイン 7.8 - 10.0 無色 -
赤紫 【弱塩基から強塩基に反応】
さて、以下のような表が参考書に掲載されていると思いますが、これは酸と塩基を混合した水溶液のpHを調べるときに使用する指示薬です。
| 酸・塩基組み合わせ | |
| リトマス | 強酸と強塩基(弱でも良い) |
| メチルオレンジ | 強酸と弱塩基 |
| フェノールフタレイン | 弱酸と強塩基 |
メチルオレンジの中和点(中性ではない)は、4弱程度で、強酸で赤色に反応し、中和点で黄色に変化する。
※ リトマスはあまり試験には出題されません。
ここで、もう一度分類表を見てみましょう。指示薬の組み合わせを追加してあります。
| 強酸 |
 |
弱酸 | |
| 酸 | 塩酸(HCl) | 酢酸(CH3COOH) | |
| 硝酸(HNO3) | 硫化水素(H2S) | ||
| 硫酸(H2SO4) | ホウ酸(H3BO3) | ||
| 炭酸(H2CO3) | |||
| シュウ酸 (COOH)2 | |||
 |
 |
||
| 強塩基 | 弱塩基 | ||
| 塩基 | 水酸化ナトリウム(NaOH) | アンモニア(NH3) | |
| 水酸化カルシウム(Ca(OH)2) | |||
| 水酸化バリウム(Ba(OH)2) | |||
| 水酸化カリウム(KOH) | |||
| 炭酸ナトリウム(Na2Co3) |
下記組合せが良く出題される組合せと試薬:これらを覚えておけば、ほぼ問題に対応できます。
硝酸(強酸)と水酸化カルシウム(強塩基)→メチルオレンジ
塩酸(強酸)と炭酸ナトリウム(強塩基) →メチルオレンジ
炭酸(弱酸)と水酸化カリウム(強塩基) →フェノールフタレイン
酢酸(弱酸)と水酸化ナトリウム(強塩基) →フェノールフタレイン
※ 問題の出題率は大変高いです。追記:2014年現在、出題率が下がっています。
出題されたとしても1題2点ですので、切り捨てるなら切り捨ててもよい部分です。
まとめ
- 酸とは水素イオンH+を生じる物質でリトマスを赤くし、塩基とは水酸化物OH-を生じる物質でリトマスを青くする。
- 下記の表を覚える。(ただし、2点しか稼げない・・・)
| 強酸 |
 |
弱酸 | |
| 酸 | 塩酸(HCl) | 酢酸(CH3COOH) | |
| 硝酸(HNO3) | 硫化水素(H2S) | ||
| 硫酸(H2SO4) | ホウ酸(H3BO3) | ||
| 炭酸(H2CO3) | |||
 |
 |
||
| 強塩基 | 弱塩基 | ||
| 塩基 | 水酸化ナトリウム(NaOH) | アンモニア(NH3) | |
| 水酸化カルシウム(Ca(OH)2) | |||
| 水酸化バリウム(Ba(OH)2) | |||
| 水酸化カリウム(KOH) |
※ 極希に塩酸に水酸化ナトリウムを混合したら中性になるという記述がありますが、これはお互いの混合する量で異なります。
塩化ナトリウムと水ができると記述しているときは中性です。ちょっとだけ覚えておきましょう。

