合格の60点以上を取るために必要最低限絞り込んだ学習ポイントと問題を盛り込んだ試験対策サイトです!
It is the exam site that incorporates the problem and learning point narrowed down the minimum required to take 60 or more points pass!
このサイトは日本国家資格の「危険物取扱者」の受験対策について記載されています。資格試験の出題箇所について独自の分析により、必要最小限の内容となっております。
This site is a national qualification in Japan, "Hazardous materials engineer" are described for exam measures. The point for your own analysis of exam questions, and ordered the contents of the minimum.
リンクや広告について
当サイトには広告や別サイトへのリンクがありますので、ご確認ください。また配信事業者はCookieを使用してウェブサイト閲覧履歴に基づく広告を配信しております。
危険物取扱者に必要な基礎物理学 気体の性質
気体の性質
気体や蒸気の比重は常温常圧(0℃、1気圧)における空気1リットルの重さ(約1.293g)との比で表します。
これを蒸気(気体)比重と言います。
つまり、空気が1.000という比重であり、ガソリンの蒸気(3~4)やプロパンガス(1.50)はそれよりも数値が大きいので重いと言えます。したがって、空気中にあってはガソリン蒸気やプロパンガスは床付近に降りてゆき滞留したり、より低地を求めて流れていったりします。
気体は、一定の温度以下で強く圧縮すると液体へと変化しますが、一定の温度以上だといくら圧縮しても液体にはなりません。この凝縮点を臨界温度といいます。(物質には固有の臨界温度があります)
また、臨界温度以下で、気体を液体に変化させるのに要する圧力のことを臨界圧力と言います。
温度が下がれば、臨界圧力も小さくなります。
また、気体でも液体でも外圧を高くすると、温度が上がります。ボイル・シャルルの法則とかそんなものの理解は必要ありません。とりあえず現象を覚えておきましょう。
※ あまり試験問題にはなりませんが、物質それぞれに臨界温度があるということと、臨界温度以下に
おいて凝縮させる為に必要な圧力のことを臨界圧力という部分は頭の片隅にでもおいておきましょう。
ボイルの法則
温度を一定に保った状態では、一定質量の気体の体積は圧力に反比例します。したがって、温度が一定ならば、一定質量の気体の体積と圧力との積は一定になります。
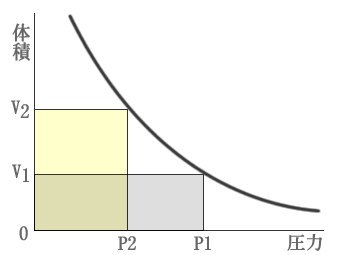 ロバート・ボイルという人物が、1661年に発見した法則であり、以下のような式になります。
ロバート・ボイルという人物が、1661年に発見した法則であり、以下のような式になります。
P1×V1=P2×V2
まぁ、正直だから何だと言うことになります。
ここで大切なのは公式よりも、その内容を理解することで、かなり当たり前のことを言っていることに注目しましょう。
要は、「圧力が高ければ、体積が小さくなって、体積が大きければ圧力は低い」という関係のことを言っているのです。
それをグラフに表したのが、上記の図になります。圧力と体積の関係がわかっていれば問題ありません。
例えば、グラフが記され関係式を選択する問題が出題されたとしても、「圧力が高ければ、体積が小さくなって、体積が大きければ圧力は低い」を思い出して、それぞれの地点に交わる部分がかけ算となる式を選択すればよいのです。試験に合格することだけを考えれば、式を暗記する方が手っ取り早いですが、当たり前のことを言っているだけの法則ですので、当たり前のことを元に問題を解いた方が間違いは起こりません。
ちなみに、乙4類の試験ではボイルの公式を用いる計算問題はほぼ出題されません。(ここにこうやって書いてしまうと出題されてしまうかもしれませんが・・・。)
シャルルの法則
圧力を一定に保った状態では、一定質量の気体の体積は、温度1℃上昇又は下降する毎に、0℃における体積の1/273ずつ膨張又は収縮する。
ジャック・シャルルによって1787年に発見された法則です。発表は違う人が行ったのですが、そのあたりでおもしろいエピソードは知りません。
他の参考書などではもう少し詳しいことが説明されていますが、これ以上の情報は必要ありません。
※ 絶対に上記の赤文字黄色マーカーの部分は忘れないようにしましょう。
※ ボイル・シャルルの法則とかは覚えなくても大丈夫です。
※ 理想気体とかも覚えなくて大丈夫です。
※ 気体定数とかもいりません。
※ ドルトンの法則も覚えなくて結構です。
まとめ
- 気体を圧縮すると液体に戻る
- 気体が一定の温度以上だといくら圧縮しても液体に戻らない現象が起こる。その温度のことを臨界温度という。
- 温度を一定に保つと一定質量の気体の体積は圧力に反比例し、体積と圧力の積(かけ算)は一定となる。
P1×V1=P2×V2これをボイルの法則という。 - 圧力を一定に保つと一定質量の気体の体積は、温度1℃上昇又は下降する毎に、0℃における体積の1/273ずつ膨張又は収縮する。

